
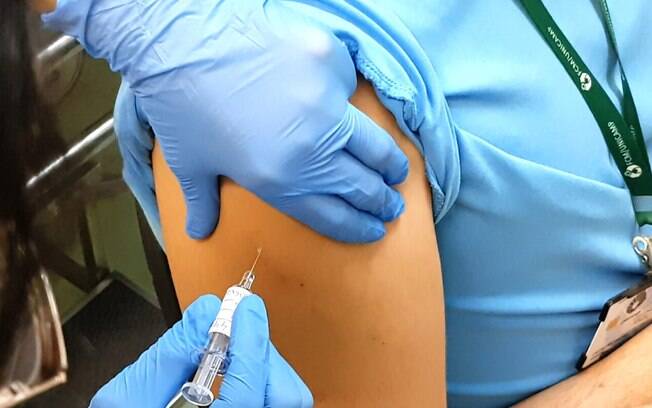
O HC (Hospital de Clínicas) da Unicamp anunciou nesta quarta-feira (7) que vai começar a testagem da vacina contra o novo coronavírus em mais 500 voluntários.
As aplicações começam ainda hoje e agora serão feitas em voluntários que sejam da área da saúde, mas que tenham mais de 60 anos. Até então a vacina era aplicada apenas em voluntários com idade até 59 anos. Segundo o hospital, nessa nova etapa também não haverá a verificação se a pessoa já se contaminou pela doença.
No último dia 22, a universidade declarou que já havia encerrado a aplicação da vacina entre os 500 voluntários que participaram 3ª fase da pesquisa do medicamento. Até então, ainda não havia previsão para um novo grupo.
Segundo a Unicamp, a ampliação de mais voluntários nos estudos clínicos foi requerida pelo Instituto Butantan e aprovada pela Anvisa (Agência Nacional de Vigilância Sanitária). Com isso, a quantidade de voluntários foi ampliada de 9 mil para 13 mil pessoas que tenham interesse em participar dos estudos.
O HC foi escolhido em julho como um dos 12 centros selecionados no Brasil para a testagem da vacina, e foi o sexto a iniciar a testagem, aplicando a primeira dose em voluntários no dia 6 de agosto.
Ao todo, segundo os responsáveis, o estudo tem previsão de duração de 14 meses, sendo 12 com acompanhamento clínico dos voluntários. A vacina é aplicada em duas doses, com intervalo de 14 dias em cada voluntário, sendo que grupos dos voluntários foram chamados aos poucos, em prazos diferentes.
Entre os 1 mil voluntários que participarão do estudo do HC, metade recebe a vacina, que contém o vírus inativo, e metade recebe o placebo- medicamento neutro que não contém efeito direto em doenças. Dessa forma, os pesquisadores colhem análises e observam a eficácia da vacina.
Entre o perfil de voluntários, não são permitidos ainda pessoas com doenças instáveis, que precisem de medicações que alterem a resposta imune, ou mulheres grávidas.
Você viu?
A VACINA
A CoronaVac, como é chamada, é uma é uma das grandes candidatas contra o vírus, e é desenvolvida pelo Instituto Butantan, em parceria com a farmacêutica chinesa Sinovac Biotech.
No Brasil, os centros fazem atualmente testes clínicos de fase III em voluntários com o objetivo de demonstrar sua eficácia e segurança.
Segundo a Unicamp, a vacina é uma das mais promissoras do mundo, porque utiliza uma tecnologia já conhecida e amplamente aplicada em outras vacinas. Por isso, o Instituto Butantan avalia que sua incorporação ao sistema de saúde deva ocorrer mais facilmente.
"O laboratório com sede em Pequim já realizou testes do produto em milhares de voluntários na China, nas fases I e II. Antes, o modelo experimental aplicado em macacos apresentou resultados expressivos em termos de resposta imune contra as proteínas do vírus", afirmou a Universidade.
Caso a vacina seja aprovada, a Sinovac e o Butantan vão firmar acordo de transferência de tecnologia para produção em escala industrial tanto na China quanto no Brasil para fornecimento gratuito ao SUS (Sistema Único de Saúde).
"A união da experiência do Butantan na produção de imunobiológicos aos esforços da Sinovac permitirá que logo o país tenha uma vacina efetiva e segura contra a Covid-19, protegendo as pessoas e salvando milhares de vidas", afirmou o diretor do Instituto Butantan, Dimas Covas.
EXPECTATIVA
No último dia 20 de setembro, o governador de São Paulo, João Doria (PSDB) declarou que o Estado deve receber, já em outubro, 5 milhões de doses da vacina CoronaVac.
Segundo Doria, a previsão é de que haja 46 milhões de doses até dezembro. O governador fez uma postagem nas redes sociais onde explicou que a ampliação de vacinas será possível em virtude da transferência de tecnologia da farmacêutica para o instituto, que passará a produzir o imunizante.
No dia 14 de setembro, o governo estadual informou que o instituto irá iniciar, em novembro, obras para ampliar sua estrutura física, a fim de acelerar a produção de vacinas.
A previsão do governo do Estado de São Paulo é começar a aplicar o fármaco na população em geral já em janeiro de 2021, logo após a liberação da Anvisa (Agência Nacional de Vigilância Sanitária).
Em todo o país, até agora, nenhum voluntário apresentou efeitos adversos graves.
